
De ophoping van oplosbaar en onoplosbaar geaggregeerd bèta-amyloïde (Aβ) kan het pathologisch proces van de ziekte van Alzheimer mogelijk initiëren. Het gehumaniseerde IgG1 monoklonale antilichaam lecanemab bindt met een hoge affiniteit aan Aβ oplosbare protofibrillen. In een nieuw onderzoek van van Dyck et al. werd onderzocht of lecanemab van toegevoegde waarde zou kunnen zijn voor mensen met vroege alzheimer.1
De fase III-studie was multicenter, dubbelblind en volgde voor 18 maanden mensen van 50-90 jaar met vroege alzheimer. Zij vertoonden een milde cognitieve beperking of milde dementie door de alzheimer en hadden amyloïd-afzettingen, zoals gezien op een PET-scan of in een cerebrospinaal vloeistoftest. Deelnemers werden 1:1 gerandomiseerd naar intraveneuze lecanemab (10 mg/kg lichaamsgewicht per 2 weken) of placebo. Het belangrijkste eindpunt was de verandering in de score van de ‘Clinical Dementia Rating–Sum of Boxes’ (CDR-SB) tussen aanvang van de studie en 18 maanden. Verder werd gekeken naar de amyloïdlast op PET, de score op de cognitieve subschaal van de ‘Alzheimer’s Disease Assessment Scale’ (ADAS-cog14), de ‘Alzheimer’s Disease Composite Score’ (ADCOMS), en de score op de ‘Alzheimer’s Disease Cooperative Study–Activities of Daily Living Scale for Mild Cognitive Impairment’ (ADCS-MCI-ADL).
Totaal werden 1.795 mensen met vroege alzheimer geïncludeerd, waarvan 898 gerandomiseerd werden naar lecanemab en 897 naar placebo. Bij de aanvang van de studie was de CDR-SB-score in beide groepen gelijk, namelijk gemiddeld 3,2. Na 18 maanden was bij mensen die behandeling met lecanemab hadden ontvangen deze score, en dus de beperking, minder toegenomen, namelijk met 1,21 tegenover 1,66 met placebo (verschil [95%-BI]: -0,45 [-0,67 tot -0,23]; p<0,001). Zie Figuur 1.
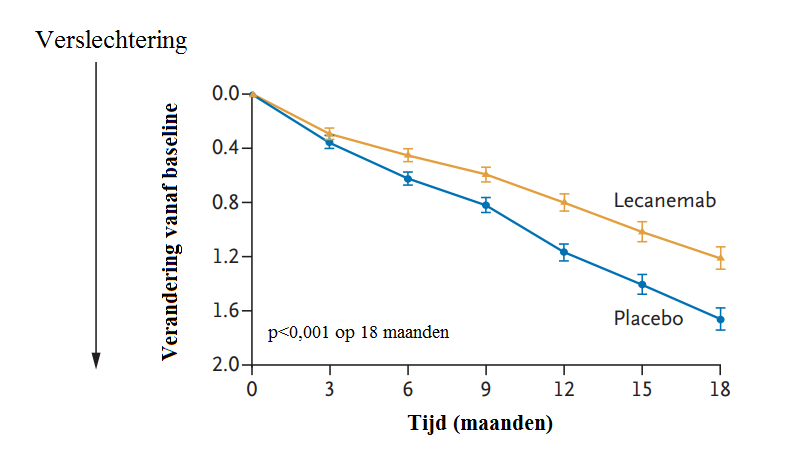
Daarnaast werd in een analyse van een subgroep (n=698) gezien dat alzheimerpatiënten een grotere afname in de amyloïdlast vertoonden wanneer zij lecanemab ontvingen in vergelijking met placebo (verschil [95%-BI]: -59,1 centiloïden [-62,6 tot -55,6]; p<0,001). Verder was de ADAS-cog14-score minder toegenomen bij lecanemab (+4,14) dan met placebo (+5,58; p<0,001), een indicatie dat de behandeling leidde tot minder cognitieve verslechtering. Tevens bleef de ADCS-MCI-ADL-score hoger met lecanemab (-3,5) in vergelijking met placebo (-5,5; p<0,001), wat een indicatie is van minder beperking in de dagelijkse activiteiten.
Wel werden diverse bijwerkingen gezien; zo leidde lecanemab-behandeling tot infusiegerelateerde bijwerkingen bij 26,4% van de participanten (7,4% met placebo) en werd bij 12,6% amyloïd-gerelateerde imaging-abnormaliteiten gezien met oedeem of hersenbloedingen (1,7% in placebo-arm). De meeste van deze imaging-afwijkingen waren mild of gemiddeld van aard (91%), asymptomatisch (78%) en verdwenen binnen 4 maanden na detectie (81%). Ernstige bijwerkingen kwamen daarnaast voor bij 14,0% van de patiënten in de lecanemab-arm en bij 11,3% van de placebogroep, waarvan infusiegerelateerde bijwerkingen het meest gezien werden. Het aantal overlijdens was niet verhoogd in de lecanemab-arm 0,7% tegenover 0,8% met placebo.
In deze studie werd gezien dat een tweewekelijkse behandeling met lecanemab leidde tot een verbetering in de amyloïdmarkers en een vertraagde toename in beperkingen in cognitie, functioneren en dagelijkse activiteiten. Wel werden verschillende bijwerkingen gezien. Begin 2023 is lecanemab door de FDA goedgekeurd als behandeling voor de ziekte van Alzheimer.2 Verwacht wordt dat lecanemab in Nederland in ieder geval nog niet voor 2025 wijdverbreid beschikbaar zal zijn.3
Referenties