
In de fase III-studie CHAMPION MG werden de effectiviteit en het bijwerkingenprofiel van ravulizumab onderzocht bij volwassenen met anti-acetylcholinereceptorantilichaam-positieve gegeneraliseerde myasthenia gravis (gMG). Hier werd al na één week in de behandelperiode een afname gezien in de impact van gMG op het dagelijks functioneren bij patiënten die werden behandeld met ravulizumab, in vergelijking met placebo. Gedurende de zeven maanden follow-up hield dit effect aan. De data werd gepresenteerd door dr. Tuan Vu (University of South Florida, Tampa, VS).
Bij circa 85% van de patiënten met gegeneraliseerde myasthenia gravis (gMG) leidt binding van autoantilichamen aan de postsynaptische acetylcholinereceptor (AChR) tot activatie van de complementcascade, de vorming van het humane terminale complementeiwit C5, en uiteindelijk, het genereren van het ‘membrane attacking complex’ (MAC), wat vervolgens resulteert in de afbraak van het postsynaptische membraan van de neuromusculaire junctie.
Ravulizumab is een gehumaniseerd monoklonaal antilichaam met een hoge affiniteit voor C5. Eerder werd al aangetoond dat bij ravulizumabbehandeling al na de eerste dosis een complete terminale complementinhibitie wordt gezien (serum vrij C5: <0,5 µg/ml). Hierop voortbordurend is CHAMPION MG opgezet: een gerandomiseerde, dubbelblinde, placebogecontroleerde, multinationale fase III-studie met een behandelperiode van 26 weken.
Volwassenen patiënten met anti-AChR-positieve gMG werden 1:1 gerandomiseerd naar ravulizumab (n=86) of placebo (n=89). Het gelijktijdig gebruik van een stabiele dosis pyridostigmine of immunosuppressiva was toegestaan tijdens de behandeling. De patiënten ontvingen de dosis ravulizumab op basis van gewicht; de laaddosis was 2.400/2.700/3.000 mg op dag 1, gevolgd door een onderhoudsdosis van 3.000/3.300/3.600 mg op dag 15 en daarna elke 8 weken. Het primaire eindpunt van de studie was verandering ten opzichte van baseline tot week 25 in de MG-ADL-totaalscore. De door de patiënt gerapporteerde MG-ADL-score laat de impact van de myasthenia gravis zien op dagelijkse activiteiten (‘activities of daily living’, ADL). Daarbij komt een hogere score overeen met een grotere beperking op bijvoorbeeld ademhaling, zicht en praten.
De patiëntkenmerken van beide studiearmen waren in balans. Bij bijna alle mensen viel de MG in klasse II (milde spierzwakte; 44-45%) of klasse III (gemiddelde spierzwakte; 48-51%). Circa 90% van de patiënten gebruikte immunosuppressiva.
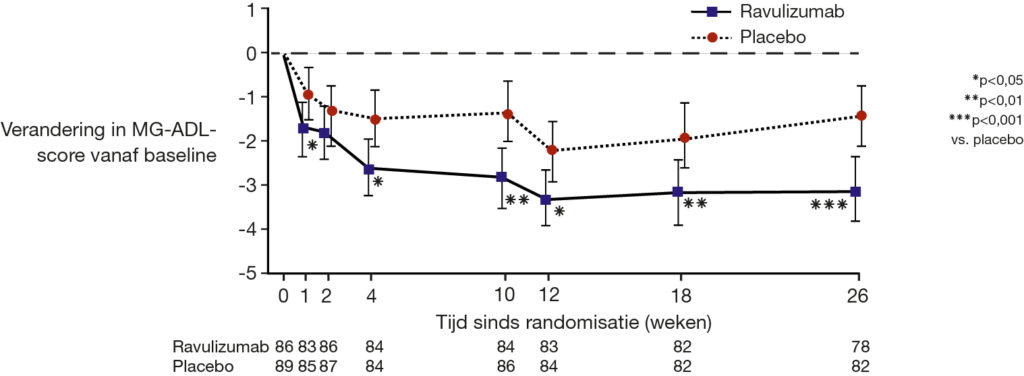
Het primaire eindpunt van CHAMPION MG werd gehaald; patiënten die werden behandeld met ravulizumab vertoonden al vanaf week 1 van de behandelperiode een significante verlaging in de totale MG-ADL-score (p<0,05) en deze daling bleef aanwezig tot het einde van de studieperiode (p<0,001, zie Figuur 1). Daarnaast werd ook een significant verschil in de MG-ADL-score gezien tussen placebo en ravulizumab op week 26: het verschil was -1,6 (95%-BI: -2,6 tot -0,7; p=0,0009). Na 26 weken was de MG-ADL-score met ravulizumab afgenomen met -3,1 en met placebo met -1,4.
Als secundair eindpunt werd gekeken naar de QMG-score, waarmee spierkracht en uithoudingsvermogen worden gekwantificeerd en een hogere score een ernstigere beperking indiceert. Hierin werd ook al binnen een week sinds de start van de behandeling een significante afname (p<0,01) gezien. Deze verbetering bleef ook significant verlaagd tot week 26 (p<0,001). Tevens werd een grotere afname in de QMG-score gezien bij behandeling met ravulizumab (-2,8) ten opzichte van placebo (-0,8; verschil: -2,0; p=0,0009) in week 26. Er werd echter geen significant verschil gezien in gezondheidsgerelateerde kwaliteit van leven (MG-QoL15r) en vermoeidheid (Neuro-QoL Fatigue) tussen de behandelingen. Wel zagen de onderzoekers bij patiënten in de placebo-arm vaker klinische achteruitgang (bij 17% van de patiënten) ten opzichte van de ravulizumab-arm (9%).
De behandeling met ravulizumab werd goed verdragen en gerapporteerde bijwerkingen waren passend bij het reeds bekende bijwerkingenprofiel van ravulizumab. Behandelingsgerelateerde bijwerkingen werden in beide armen gerapporteerd bij 34% van de patiënten. De meeste bijwerkingen waren mild. Wel werd bij 27% van de ravulizumab-behandelde patiënten een graad 3/4-bijwerking gezien en overleden 2 patiënten. In de placebo-arm werd bij 17% van de patiënten een graad 3/4-bijwerking gezien, en hier overleed geen van de patiënten. Er werden in deze studie geen gevallen van meningokokkeninfectie gezien.
Referentie
Vu T. Efficacy and Safety of Ravulizumab, a Long-acting Terminal Complement Inhibitor, in Adults with Anti-Acetylcholine Receptor Antibody-Positive Generalized Myasthenia Gravis: Results from the Phase 3 CHAMPION MG Study. Gepresenteerd tijdens AAN 2022;PL3-4.